
H2FOZ – Paulo Bogler
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a farmacêutica AstraZeneca a retomar no Brasil os testes da vacina contra a covid-19, a partir desta segunda-feira, 14. Chamado de “vacina de Oxford”, em alusão à universidade do Reino Unido, o imunizante está na fase 3 de análise. As informações são da Agência Brasil (ABr).
A testagem havia sido suspensa em outros países na semana passada, depois que uma voluntária relatou reações. Conforme a ABr, técnicos da Anvisa avaliaram no sábado, 12, as informações recebidas da agência reguladora britânica (Medicines and Healthcare Products Regulatory Agency – MHRA), do Comitê Independente de Segurança do estudo clínico e da farmacêutica AstraZeneca.
“Após avaliar os dados do evento adverso, sua causalidade e o conjunto de dados de segurança gerados no estudo, a Agência concluiu que a relação benefício/risco se mantém favorável e, por isso, o estudo poderá ser retomado”, informou a Anvisa, por meio de nota.
Segundo a agência sanitária brasileira, o acompanhamento seguirá, abrangendo “todos os eventos adversos observados durante o estudo e, caso seja identificada qualquer situação grave com voluntários brasileiros, irá tomar as medidas cabíveis para garantir a segurança dos participantes”.
Contrato entre a Fundação Oswaldo Cruz (Fiocruz) e a AstraZeneca garante o acesso a 100,4 milhões de doses do Ingrediente Farmacêutico Ativo (IFA) para o processamento final da vacina e controle de qualidade. De acordo com a Agência Brasil, a parceira “garante à Fiocruz a transferência total da tecnologia”.
O governo destinou crédito extraordinário de R$ 1,9 bilhão para o Ministério da Saúde, para o custeio da vacina chamada de ChAdOx1 nCoV-19.
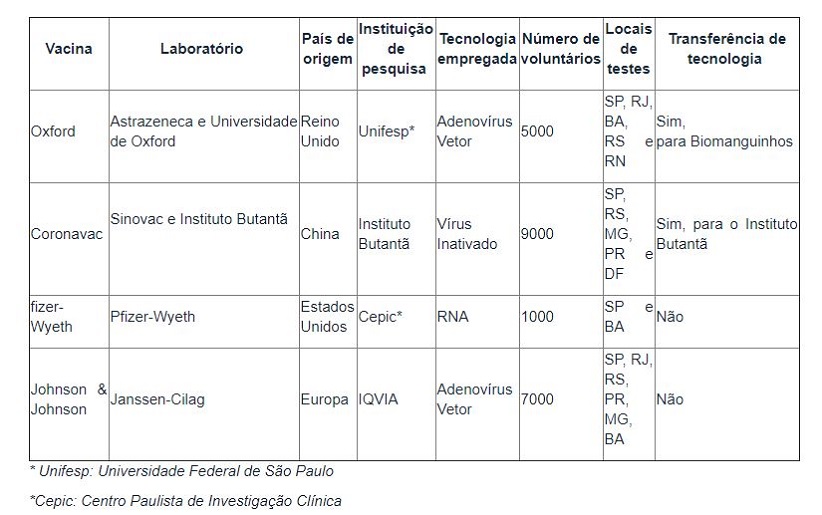
Mapa das vacinas em teste no Brasil
De acordo com a Anvisa, quatro vacinas estão sendo testadas no país. Elas reúnem 22 mil voluntários do Paraná, São Paulo, Rio de Janeiro, Rio Grande do Sul, Minas Gerais, Distrito Federal, Bahia e Rio Grande do Norte.
Os imunizantes são os seguintes:
– Oxford – AstraZeneca e Universidade de Oxford (Reino Unido);
– Coronavac – Sinovac e Instituto Butantã (China);
– Pfizer-Wyeth – Pfizer-Wyeth (Estados Unidos); e
– Johnson & Johnson – Janssen-Cilag (Europa).
Russa
A agência cita ainda a vacina russa, cujo processo de registro é tratado pela Anvisa, Governo do Paraná e Instituto de Tecnologia do Paraná (Tecpar). O desenvolvimento clínico desse medicamento é conduzido fora do Brasil.
“Nesse sentido, a Anvisa está em tratativas e já realizou reuniões com membros sobre o processo de registro da vacina desenvolvida pela Rússia. Essas reuniões são de caráter preliminar, antecipando possíveis demandas futuras”, explica a agência sanitária, em nota publicada em seu site.



Comentários estão fechados.